本期以内窥镜手术用剪为例,拆解国内二类医疗器械注册审查要求。
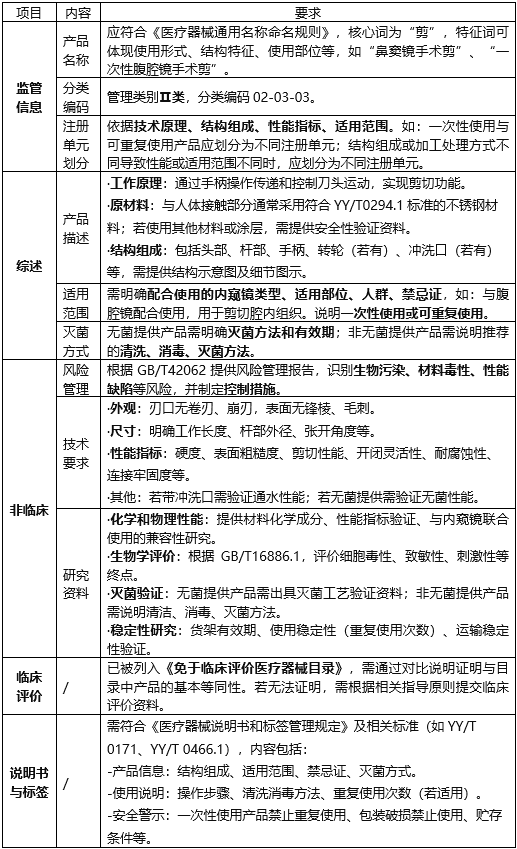
-产品名称:应符合《医疗器械通用名称命名规则》,核心词为“剪”,特征词可体现使用形式、结构特征、使用部位等,如“鼻窦镜手术剪”“一次性腹腔镜手术剪”。
-分类编码:管理类别为Ⅱ类,分类编码为02-03-03。
-注册单元划分:以技术原理、结构组成、性能指标和适用范围为依据。例如:一次性使用与可重复使用产品应划分为不同注册单元。结构组成或加工处理方式不同导致性能或适用范围不同时,应划分为不同注册单元。
2.综述资料-产品描述:
·工作原理:通过手柄操作传递和控制刀头运动,实现剪切功能。
·原材料:与人体接触部分通常采用符合YY/T 0294.1的不锈钢材料,若使用其他材料或涂层,需提供安全性验证资料。
·结构组成:包括头部、杆部、手柄、转轮(若有)、冲洗口(若有)等,需提供结构示意图及细节图示。
-适用范围:需明确配合使用的内窥镜类型、适用部位、人群及禁忌证,如“与腹腔镜配合使用,用于剪切腔内组织”。同时说明产品为一次性使用或可重复使用。
-灭菌方式:无菌提供产品需明确灭菌方法和有效期;非无菌提供产品需说明推荐的清洗、消毒和灭菌方法。
3.非临床资料-风险管理:依据GB/T 42062提供风险管理报告,识别生物污染、材料毒性、性能缺陷等风险,并制定控制措施。
-产品技术要求:
·外观:刃口无卷刃、崩刃,表面无锋棱、毛刺。
·尺寸:明确工作长度、杆部外径、张开角度等。
·性能指标:包括硬度、表面粗糙度、剪切性能、开闭灵活性、耐腐蚀性、连接牢固度等。
·其他:若带冲洗口,需验证通水性能;若为无菌提供,需验证无菌性能。
-研究资料:
·化学和物理性能:提供材料化学成分、性能指标验证及与内窥镜联合使用的兼容性研究。
·生物学评价:依据GB/T 16886.1,对细胞毒性、致敏性、刺激性等终点进行评价。
·灭菌验证:无菌提供产品需提供灭菌工艺验证资料;非无菌提供产品需说明清洁、消毒和灭菌方法。
·稳定性研究:包括货架有效期、使用稳定性(重复使用次数)和运输稳定性验证。

产品已列入《免于临床评价医疗器械目录》,需通过对比说明证明与目录中产品的基本等同性。若无法证明,需按相关指导原则提交临床评价资料。
5.产品说明书和标签说明书和标签需符合《医疗器械说明书和标签管理规定》及相关标准(如YY/T 0171、YY/T 0466.1),内容包括:
-产品信息:结构组成、适用范围、禁忌证、灭菌方式。
-使用说明:操作步骤、清洗消毒方法、重复使用次数(若适用)。
-安全警示:一次性使用产品禁止重复使用,包装破损禁止使用,贮存条件等。