
人表皮生长因子受体2(HER2)是乳腺癌重要的驱动基因,也是靶向治疗的重要靶标,目前主要基于免疫组化(IHC)检测表达水平并辅以原位杂交(FISH)检测技术检测基因扩增状态,从而分为HER2阳性和HER2阴性两大类。传统抗HER2靶向治疗主要以HER2阳性为依据,因此仅约10-20%的乳腺癌患者能够从靶向治疗中获益。随着新型抗体药物偶联物(ADC)的问世,打破了传统抗HER2靶向治疗依赖于HER2过表达或基因扩增的局面,重塑了传统抗HER2治疗格局,推动低表达(HER2 low)和超低表达(HER2 ultralow)成为乳腺癌独立治疗靶点,不但为传统“HER2阴性”患者开辟了靶向治疗新路径,也扩大了抗HER2治疗获益人群。
01.HER2 low和HER2 ultralow定义
目前,国内外对于HER2 low和HER2 ultralow乳腺癌的概念主要参考DESTINY-Breast 04(DB04)和DESTINY-Breast 06(DB06)研究的入组标准,即HER2 low定义为IHC 1+或IHC 2+且FISH阴性,HER2 ultralow定义为IHC 0伴≤10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色[1、2]。欧洲医学肿瘤学会(ESMO)2023年发布的《ESMO expert consensus statements (ECS) on the definition, diagnosis, and management of HER2-low breast cancer》和中国临床肿瘤学会(CSCO)2025年发布《乳腺癌诊疗指南2025》均已新增了HER2 low和HER2 ultralow概念,以更好地指导HER2检测结果的表达,实现HER2表达状态更精准的分层(图1、图2)[3、4]。

图1 ESMO指南关于HER2 low和HER2 ultralow定义

图2 CSCO指南关于HER2 low和HER2 ultralow定义
02.HER2 low和HER2 ultralow治疗原则
虽然HER2表达状态新增了HER2 low和HER2 ultralow两个分类,但并不是将HER2 low和HER2 ultralow定义为HER2表达状态的新亚型。目前国内外指南对于HER2表达状态依然采用二分类法,即阳性和阴性,而HER2 low和HER2 ultralow归类于HER2阴性[3、4]。因此,HER2 low和HER2 ultralow乳腺癌患者的初始治疗方案还是推荐基于分子分型(Luminal A型、Luminal B型、HER2阳性型、Basal-like型)框架,即激素受体阳性(HR+)且HER2 low/ultralow患者,参照Luminal A型和Luminal B型治疗方案,推荐CDK4/6抑制剂为主的内分泌治疗或紫杉为主的化疗,CDK4/6抑制剂治疗失败后,可考虑ADC药物;激素受体阴性性(HR-)且HER2 low/ultralow患者,参照Basal-like型治疗方案,推荐化疗或化疗联合免疫治疗,一线治疗失败后,应首选ADC治疗(图3、图4)[4、5]。
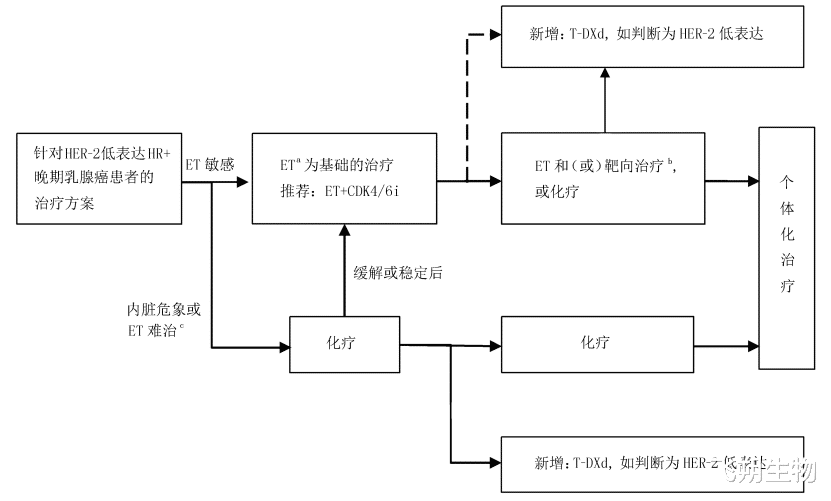
图3 HER2低表达HR+晚期乳腺癌患者的治疗路径

图4 HER2低表达HR-晚期乳腺癌患者的治疗路径
03.HER2 low和HER2 ultralow临床研究
德曲妥珠单抗(T-DXd)是新一代ADC药物,在临床前研究中表现出对于HER2 low肿瘤的潜在治疗作用。DESTINY-Breast 04研究是首个在HER2 low人群中验证T-DXd疗效的Ⅲ期临床试验,该研究入组了557例既往接受过一线或二线化疗的HER2 low不可切除/转移性乳腺癌患者,按2:1随机分配到T-DXd组或医生选择的化疗组(TPC,如卡培他滨、艾立布林、吉西他滨、紫杉醇或白蛋白紫杉醇)[1]。结果显示,中位随访18.4个月(数据截至2022年1月11日),在总人群中,T-DXd组的中位无进展生存期(mPFS)相较于TPC组显著延长4.8个月(9.9个月vs 5.1个月,HR=0.50),中位总生存期(mOS)显著延长6.6个月(23.4个月vs 16.8个月,HR=0.64)(图5、图6)[1]。基于该研究的结果,美国FDA于2022年8月批准T-DXd用于经治失败的、不可切除或转移性HER2 low乳腺癌患者。中国NMPA于2023年7月批准T-DXd用于既往在转移性疾病阶段接受过至少一种系统治疗的,或在辅助化疗期间或完成辅助化疗之后6个月内复发的,不可切除或转移性HER2 low成人乳腺癌患者。
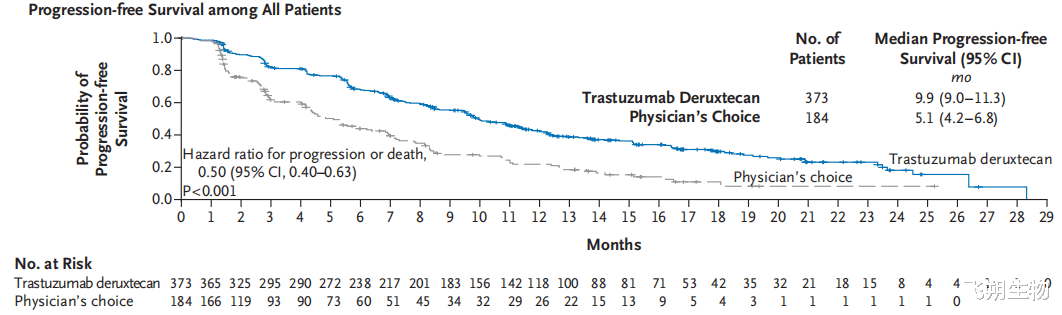
图5 DESTINY-Breast 04研究(中位随访18.4个月)PFS

图6 DESTINY-Breast 04研究(中位随访18.4个月)OS
另外,DB04研究已公布了长期随访数据,中位随访32.0个月(数据截至2023年3月1日),在总人群中,T-DXd组和TPC组mPFS分别为8.8个月和4.2个月(HR=0.36),mOS分别为22.9个月和16.8个月(HR=0.69),再次证实T-DXd在HER2 low晚期乳腺癌中的卓越疗效与持久生存获益(图7、图8)[6]。

图7 DESTINY-Breast 04研究(中位随访32.0个月)PFS

图8 DESTINY-Breast 04研究(中位随访32.0个月)OS
在DB04研究的基础上,DESTINY-Breast 06研究进一步扩大HER2治疗获益人群(HER2 ultralow),证实了T-DXd可使HER2 ultralow人群获益。DESTINY-Breast 06研究是一项全球、随机、开放标签的Ⅲ期临床试验,共入组了866例既往接受过≥一线内分泌治疗且未接受过化疗的晚期乳腺癌患者,按1:1随机分配至T-DXd组或TPC组(如卡培他滨、白蛋白紫杉醇、紫杉醇)[2]。结果显示(数据截至2024年3月18日),研究已达到主要终点,在HR+/HER2 low人群中,T-DXd组的PFS相比TPC组显著延长5.1个月(13.2个月 vs 8.1个月,HR=0.62)(图9)。另外,在HER2 ultralow人群中,T-DXd组也展现出了获益趋势(13.2个月 vs 8.3个月,HR=0.78)(图10)[2]。该研究的疗效数据突破了HR+/HER2 low乳腺癌患者的内分泌治疗困境,并且HER2 ultralow人群与HER2 low人群获益一致,有望进一步拓展德曲妥珠单抗的治疗获益人群,为更多患者带来治疗希望。

图9 DESTINY-Breast 06研究HR+/HER2 low人群PFS

图10 DESTINY-Breast 06研究HR+/HER2 ultralow人群PFS
04.小结
随着DESTINY-Breast 04与DESTINY-Breast 06研究的突破性进展,乳腺癌HER2表达的诊疗边界被重新定义,HER2 low及HER2 ultralow已成为乳腺癌精准治疗的关键靶标。据统计,45%~55%的乳腺癌呈现HER2 low状态,提示约半数乳腺癌患者可获益于针对HER2的靶向治疗,打破了仅HER2阳性乳腺癌患者可获益于抗HER2靶向治疗的局限,大大扩展了抗HER2治疗获益人群[5]。然而,目前在HER2 low/ultralow的检测和诊断上仍存在诸多挑战,未来的研究需要进一步优化HER2的检测方法,能更加准确地识别HER2 low/ultralow乳腺癌,为患者提供更加精准、个性化的治疗方案[7]。
参考文献
[1] New England Journal of Medicine,2022,387(1): 9-20.
[2] England Journal of Medicine,2024,391(22):2110-2122.
[3] ESMO expert consensus statements (ECS) on the definition,diagnosis,and management of HER2-low breast cancer
[4]乳腺癌诊疗指南(2025版)
[5]人表皮生长因子受体2低表达乳腺癌临床诊疗共识(2022版)
[6] Nature Medicine,2025: 1-9.
[7]乳腺癌HER2检测指南(2024版)
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!