1月9日,苏州信诺维医药科技股份有限公司(简称:信诺维)申请上交所科创板上市审核状态变更为“已问询”,国泰海通证券为其保荐机构,拟募资29.40亿元。
据招股书,公司是一家聚焦于全球范围内重大未满足临床需求,以疾病为导向,致力于将创新转化为临床价值,为患者提供疾病领域内最佳治疗药物的创新药公司。公司已形成“1(NDA)+3(III期)+N”的创新药管线2梯队,并通过全球BD3授权或转让初步实现了以研养研。
截至招股说明书签署日,公司针对抗肿瘤、抗感染等多个市场空间广阔的重大疾病领域,开发了10款主要在研创新药管线,其中:(1)抗肿瘤领域的XNW5004(EZH2抑制剂)、XNW27011(Claudin18.2靶向ADC)以及XNW28012(TF靶向ADC)均处于III期或关键性临床研究阶段,上述药物均展现出优异的临床疗效,可以为胰腺癌、胃癌、前列腺癌、外周T细胞淋巴瘤等重大疾病领域提供“从无到有”或“从有到优”的治疗手段,上述在研管线均已获得中国国家药品监督管理局药品审评中心(CDE)的突破性治疗药物认定,且XNW27011以及XNW28012已获得美国食品药品监督管理局(FDA)的快速通道认定(FastTrackDesignation,FTD),XNW28012已获得美国FDA的孤儿药认定(OrphanDrugDesignation,ODD);
(2)抗感染领域的注射用亚胺西福(由公司自主研发的新型β-内酰胺酶抑制剂福诺巴坦(XNW4107)与亚胺培南、西司他丁钠组成的复方制剂)用于治疗革兰阴性菌引起的医院获得性细菌性肺炎(HABP)和呼吸机相关性细菌性肺炎(VABP)的药品上市许可申请(NDA)已获得受理,预计2026年可实现获批上市,将助力解决国内革兰阴性菌抗生素耐药困境,注射用亚胺西福已获得美国FDA的合格感染疾病产品认证(QualifiedInfectiousDrugProduct,QIDP)以及快速通道认定(FTD)。
除上述进入NDA和临床后期的管线外,公司尚有多个具有差异化机制和较高临床价值的早期管线处于稳步有序推进中。公司在研管线获得的监管促进资格数量在国内药企中名列前茅。
在全球化视野和布局的加持下,公司通过全球BD已初步实现“以研养研”的模式,公司首个药品预计于2026年上市,公司将进入研发驱动,BD和销售的一体化增长阶段,具体如下:(1)公司已初步实现BD交易的常态化,在快速兑现公司管线价值的同时,也体现出跨国药企和国内知名上市药企对公司研发能力和管线价值的认可。截至招股说明书签署日,公司已有4条在履行中的管线对外授权合作或转让,合作方包括安斯泰来(Astellas)4等知名跨国药企以及云顶新耀(01952)、中国抗体(03681)等知名国内上市药企,协议交易金额(包括首付款、里程碑付款等)累计已超过20亿美元,其中2025年已收到1.30亿美元(税前)的不可撤销首付款,预计当年将实现公司层面的盈利(扣除非经常性损益后),已初步实现“以研养研”模式;
(2)公司首个创新药注射用亚胺西福预计将于2026年实现国内获批上市,XNW5004、XNW27011及XNW28012等3款药品已获CDE突破性治疗药物认定,预计将于2027年至2028年间陆续实现国内上市,能够持续带动公司药品销售收入的快速增长。
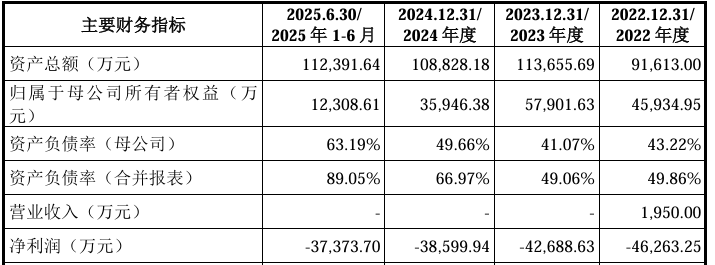
财务方面,于2022年度、2023年度、2024年度及2025年1-6月,公司实现净利润分别约为-4.63亿元、-4.27亿元、-3.86亿元、-3.74亿元人民币。