11月7日,NMPA官网宣布已于近日批准重庆精准生物申报的1类生物新药普基仑赛注射液(pCAR-19B细胞自体回输制剂)上市,用于治疗3~21岁CD19阳性的难治或复发(首次缓解12个月后复发需经挽救化疗)的急性B淋巴细胞白血病患者。此前,该药曾被CDE纳入突破性治疗和优先审评。
根据Insight数据库,精准生物的普基仑赛是国内首款获批上市用于治疗儿童白血病的CAR-T产品。
普基仑赛是重庆精准生物自主研发的CD19靶向CAR-T疗法,该药针对中国人群,对CAR结构进行优化,同时采用了更为安全的基因转导载体系统,从而具有更好的有效性和安全性。
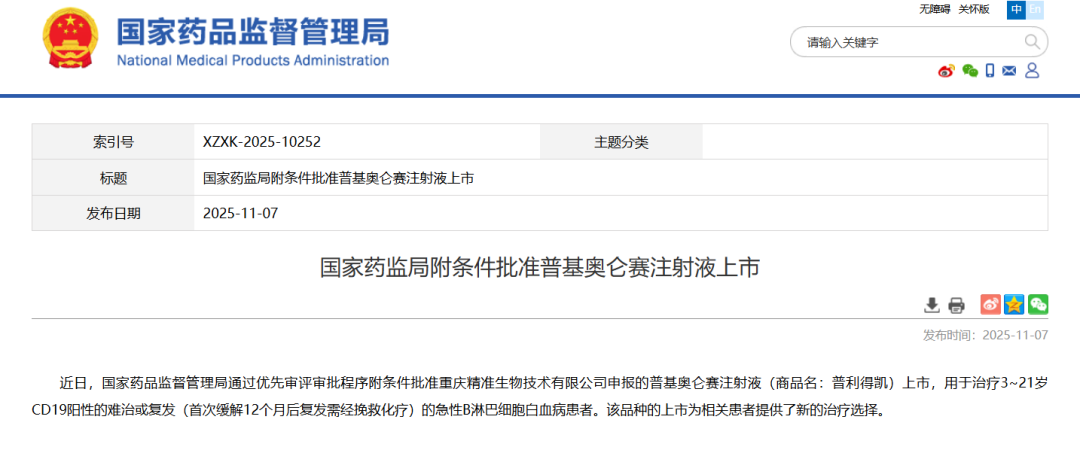
Insight数据库显示,该药最早在18年2月首次申请临床,一年后首次获批临床,19年首次公示临床,24年该药在国内提交上市申请,今日获批。
I期临床试验数据显示,入组的9例患者均获得完全缓解(CR),总体缓解率达100%,而且首次达到完全缓解的患者微小残留病变(MRD)也均为阴性。此外,临床试验中无剂量限制性毒性(DLT)以及治疗相关死亡事件发生,总体安全性和耐受性良好。
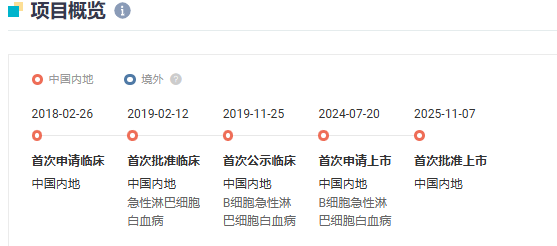
在2024年ASH大会上,该药用于CD19阳性R/RB-ALL的II期临床结果首次被披露。这是一项单组、开放标签、多中心研究,纳入筛选时年龄≥3岁且≤21岁,确诊为CD19+R/RB-ALL的患者。主要终点是3个月时总缓解率(ORR),定义为输注后3个月内完全缓解(CR)加CR伴血液不完全恢复(CRi)。
截至2024年4月18日,共入组89例患者并接受白细胞分离术,其中64例接受pCAR-19B输注。无制备失败病例。在输注患者中,6.25%为难治性,93.75%的患者复发,需接受多线治疗或异基因干细胞移植。患者中位年龄为11岁(范围:3-21岁),56.25%为男性。此外,75%的患者携带至少一种高危基因。基线骨髓原始细胞负荷中位数为58.3%,56.25%的患者骨髓原始细胞负荷较高(≥50%)。
中位随访211天,最佳ORR为90.63%,其中78.13%的患者达到CR,12.5%的患者达到CRi,超过了当前商业化抗CD19CAR-T疗法产品在R/RB-ALL中报道的疗效。
此外,98.27%的ORR患者获得了阴性微小残留病(MRD)阴性缓解。3个月ORR为76.56%。中位缓解持续时间(DOR)为10.61个月,中位总生存期(OS)为23.92个月。
在安全性方面,细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)分别发生于98.44%和50%的患者。≥3级CRS和ICANS分别发生于29.69%和39.06%的患者。≥3级CRS和ICANS的中位持续时间分别为4天和3天。无CRS或ICANS导致的死亡病例。
白血病是全球最为常见的恶性肿瘤之一,其发病总人数和每年新增人数均呈现上升趋势。其中,ALL是儿童最常见的恶性肿瘤,其发病率约(3~5)/10万,也是导致儿童和青少年死亡的主要疾病之一,其中B-ALL约占ALL的80%左右。
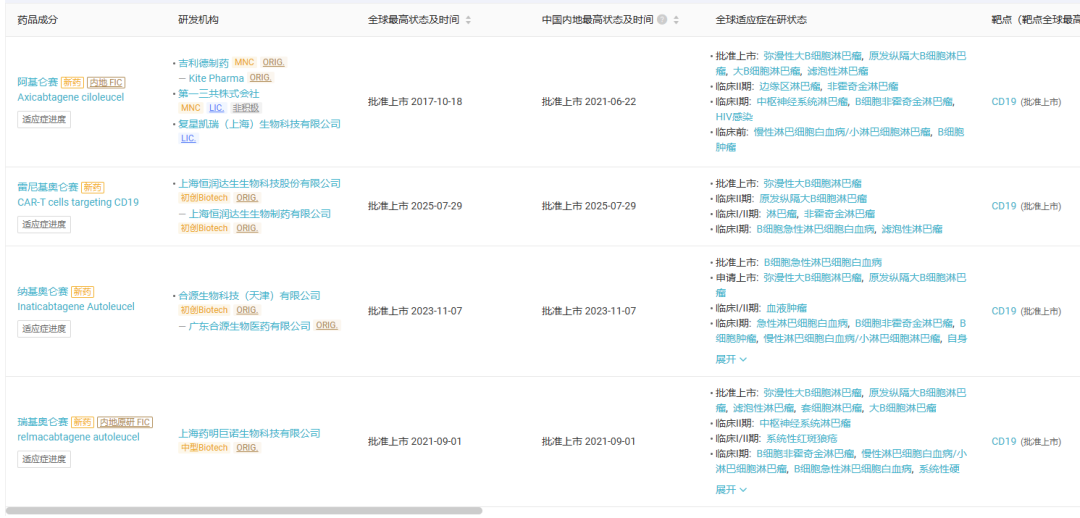
根据Insight数据库,此前国内已有4款靶向CD19的CAR-T产品获批上市,分别为复星凯特引进的的阿基仑赛、药明巨诺的瑞基奥仑赛、合源生物的纳基奥仑赛,以及恒润达生的雷尼基奥仑赛。重庆精准生物的普基仑赛是国内获批的第5款CD19CAR-T产品。
文章内容仅供参考,不构成投资建议。投资者据此操作,风险自担,关于对文中陈述、观点判断保持中立,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证。请读者仅作参考,并请自行承担全部。